HvJ EU: Datum kennisbrenging vergunningsbesluit aan adressaat is eerste vergunning
HvJ EU 6 oktober 2015; IEF 15311; C-471/14; ECLI:EU:C:2015:659 (Seattle Genetics )ABC voor medische producten. Het hof verklaart voor recht:
1) Artikel 13, lid 1, van verordening (EG) nr. 469/2009 van het Europees Parlement en de Raad van 6 mei 2009 betreffende het aanvullende beschermingscertificaat voor geneesmiddelen moet aldus worden uitgelegd dat het begrip „datum van de eerste vergunning voor het in de handel brengen in de [Europese Unie]” wordt bepaald door het Unierecht.
2) Artikel 13, lid 1, van verordening nr. 469/2009 moet aldus worden uitgelegd dat de „datum van de eerste vergunning voor het in de handel brengen in de [Unie]” in de zin van die bepaling de datum is waarop van het besluit tot verlening van een vergunning voor het in de handel brengen, ter kennis is gebracht aan de adressaat ervan.
Gestelde vragen:
1) Wordt de datum van de eerste [VHB] in de [Unie] als bedoeld in artikel 13, lid 1, van verordening nr. 469/2009 door het [Unie]recht bepaald of verwijst deze bepaling naar de datum waarop de vergunning volgens het recht van de betrokken lidstaat van kracht wordt?
2) Indien het Hof van Justitie van de Europese Unie voor recht verklaart dat de in de eerste vraag bedoelde datum door het [Unie]recht wordt bepaald, welke datum moet dan in aanmerking worden genomen: die waarop de vergunning is afgegeven of die waarop de kennisgeving heeft plaatsgevonden?
 Octrooirecht. Plantlab is rechthebbende van
Octrooirecht. Plantlab is rechthebbende van  Uitspraak ingezonden door Rien Broekstra, Ruprecht Hermans en Richard Ebbink,
Uitspraak ingezonden door Rien Broekstra, Ruprecht Hermans en Richard Ebbink,  Uitspraak mede ingezonden door Paul Reeskamp en Marijn van der Wal,
Uitspraak mede ingezonden door Paul Reeskamp en Marijn van der Wal,  Schadestaatprocedure. Begroting schade ten gevolge van niet-nakoming verplichting tot op naam van eiser stellen octrooi. Schadepost (a) - de schade bestaande uit gederfde positieve contractwaarde van de licentieovereenkomst - wordt toegewezen. De concept licentie-overeenkomst tussen Inno Nautic en Vetus omschreven de royalties in drie tranches een bedrag van €150.000. De overige schadeposten - kosten herstelprocedures, verlies van de mogelijkheid tot verkrijgen van octrooibescherming in andere landen, schade als gevolg van het faillissement van Inno Nautic en kosten voor de schadebegroting - worden afgewezen.
Schadestaatprocedure. Begroting schade ten gevolge van niet-nakoming verplichting tot op naam van eiser stellen octrooi. Schadepost (a) - de schade bestaande uit gederfde positieve contractwaarde van de licentieovereenkomst - wordt toegewezen. De concept licentie-overeenkomst tussen Inno Nautic en Vetus omschreven de royalties in drie tranches een bedrag van €150.000. De overige schadeposten - kosten herstelprocedures, verlies van de mogelijkheid tot verkrijgen van octrooibescherming in andere landen, schade als gevolg van het faillissement van Inno Nautic en kosten voor de schadebegroting - worden afgewezen. Octrooirecht. Onderneming houdster van een standaard-essentieel octrooi, die zich jegens een standaardisatieorganisatie de verbintenis is aangegaan aan derden licenties te verlenen onder eerlijke, redelijke en niet-discriminerende voorwaarden, genoemd ‚FRAND’(‚fair, reasonable and non-discriminatory’)-voorwaarden – Misbruik van machtspositie – Beroepen wegens inbreuk – Vordering tot staken – Vordering tot terugroeping van producten – Vordering tot verstrekking van boekhoudkundige gegevens uit het verleden (toegestaan) – Vordering tot schadevergoeding – Verplichtingen van de houder van het standaard-essentieel octrooi. Het hof verklaart voor recht:
Octrooirecht. Onderneming houdster van een standaard-essentieel octrooi, die zich jegens een standaardisatieorganisatie de verbintenis is aangegaan aan derden licenties te verlenen onder eerlijke, redelijke en niet-discriminerende voorwaarden, genoemd ‚FRAND’(‚fair, reasonable and non-discriminatory’)-voorwaarden – Misbruik van machtspositie – Beroepen wegens inbreuk – Vordering tot staken – Vordering tot terugroeping van producten – Vordering tot verstrekking van boekhoudkundige gegevens uit het verleden (toegestaan) – Vordering tot schadevergoeding – Verplichtingen van de houder van het standaard-essentieel octrooi. Het hof verklaart voor recht: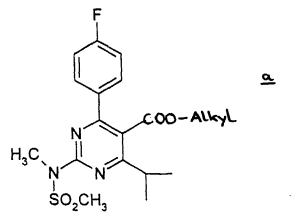 Octrooirecht. ABC. Afstandsleer. Shionogi is farmaceutische onderneming en houdster van ABC 300125 voor 'Rosuvastatinum, desgewenst in de vorm van een niet-toxisch farmaceutisch aanvaardbaar zout, in het bijzonder het calciumzout', voorheen houdster van EP471 'Pyrimidinederivaten als HMG-CoA-reductase-inhibitoren’. Resolution vordert met succes de partiële nietigheid van het octrooi en ABC vanwege toegevoegde materie; voor zover de bescherming ervan zich uitstrekt over andere producten dan in EP 471 genoemde niet-toxische farmaceutisch aanvaardbare zouten van rosuvastatine.
Octrooirecht. ABC. Afstandsleer. Shionogi is farmaceutische onderneming en houdster van ABC 300125 voor 'Rosuvastatinum, desgewenst in de vorm van een niet-toxisch farmaceutisch aanvaardbaar zout, in het bijzonder het calciumzout', voorheen houdster van EP471 'Pyrimidinederivaten als HMG-CoA-reductase-inhibitoren’. Resolution vordert met succes de partiële nietigheid van het octrooi en ABC vanwege toegevoegde materie; voor zover de bescherming ervan zich uitstrekt over andere producten dan in EP 471 genoemde niet-toxische farmaceutisch aanvaardbare zouten van rosuvastatine. Uitspraak ingezonden door namens Otto Swens en Ricardo Dijkstra,
Uitspraak ingezonden door namens Otto Swens en Ricardo Dijkstra,  Octrooirecht. Zie eerder AG [
Octrooirecht. Zie eerder AG [






















































































